Projektanslag 2020
Decoding cell fate with lineage-tracing in utero transduction
Huvudsökande:
Dr Emma Andersson
Medsökande:
Karolinska Institutet
Igor Adameyko
Niklas Björkström
Jonas Frisén
Ulrika Marklund
Lärosäte:
Karolinska Institutet
Beviljat anslag:
40 100 000 kronor under fem år
En grupp forskare vid Karolinska Institutet undersöker vad som får stamceller att i olika skeden bestämma sig för att bli en specifik sorts cell, och även vad som kan få en mogen cell att i vissa fall, till exempel på grund av sjukdom, förvandlas till andra celltyper.
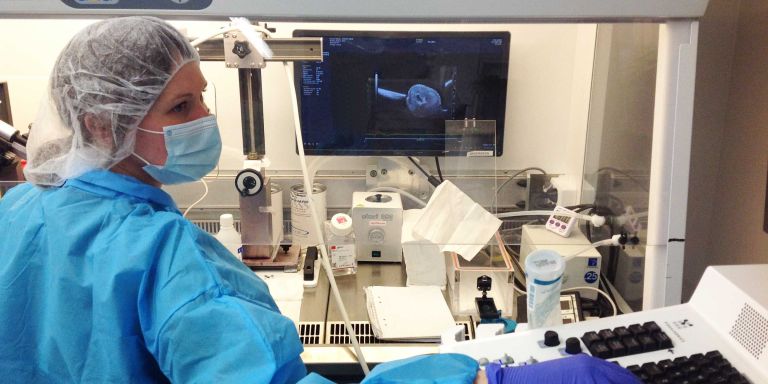
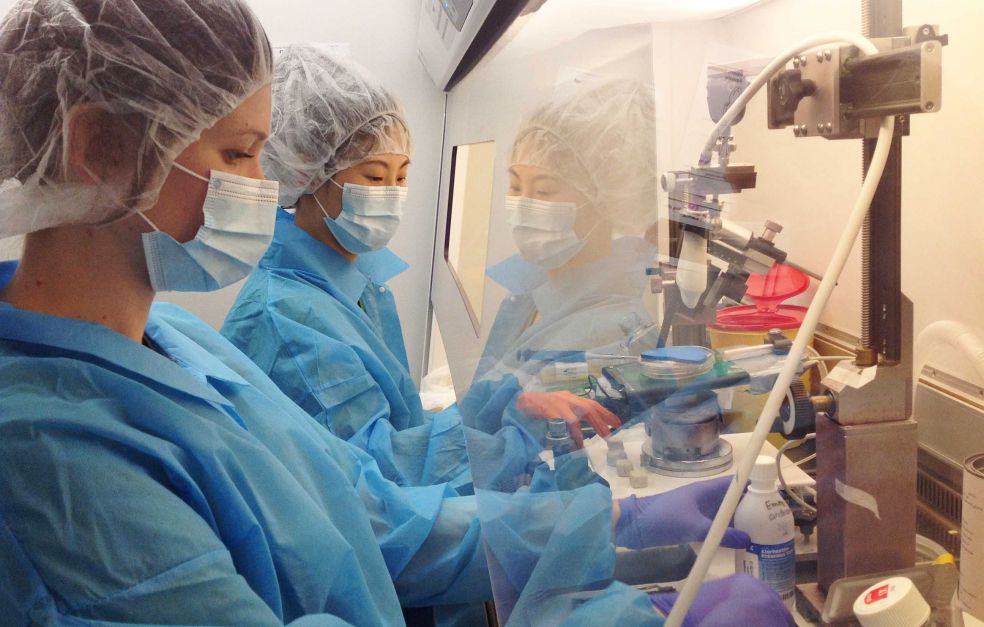
Emma Andersson är utvecklingsbiolog och huvudansvarig för projektet. Hennes grupp har utvecklat en teknik som gör det möjligt att märka in stamceller hos musfoster och följa dem vid olika tidpunkter: i fosterstadiet, efter att musen har fötts och när den är vuxen.
– Vi får helt nya möjligheter att besvara grundläggande frågor om vår biologi.
Stamcellsforskare har länge diskuterat hur man ska kunna anpassa musembryon i syfte att följa den individuella cellutvecklingen. Emma Anderssons grupp är först i världen med att ha lyckats göra det för nervsystemet med en teknik som använder färre möss.
Varje cell får en egen streckkod
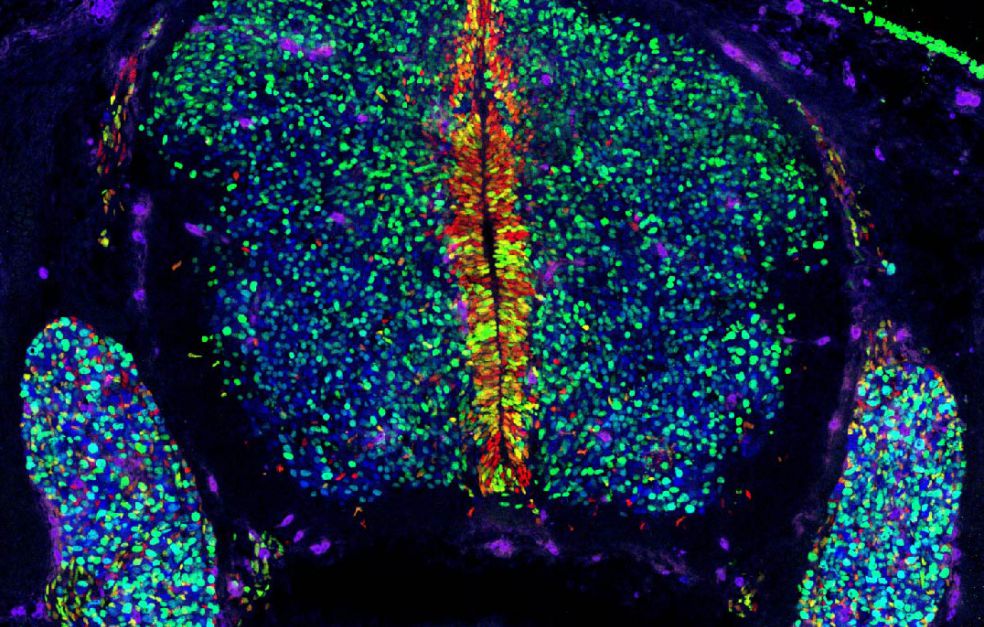
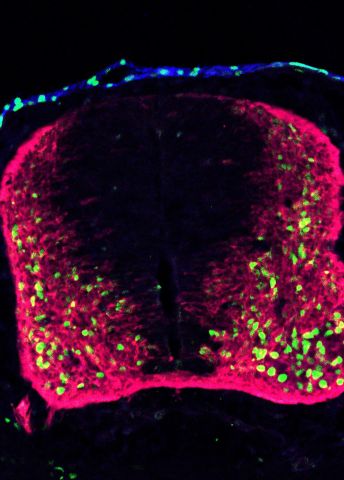
Grundidén går ut på att injicera fluorescerande signaler och ett virus i fostervattnet hos gravida möss. Viruset bär med sig en sekvens DNA, en biologisk streckkod som ger cellen ett unikt id-nummer.
– Vi integrerar en bit DNA i varje cell, vilket innebär att varje cell får en helt egen identitetsmarkör. På det sättet kan vi spåra stamcellerna under hela deras utveckling.
Emma Andersson hörde först talas om tekniken på en föreläsning med forskaren Elaine Fuchs. Senare besökte Emma hennes labb i New York för att lära sig mer.
– Tekniken utvecklades egentligen för huden, som är lätt att komma åt eftersom huden ligger på utsidan av kroppen. Men tanken slog mig att om vi kan injicera mycket tidigare så borde vi komma åt hela nervsystemet.
Både möss och människor ser ut som ett löv under fosterstadiet. ”Lövets” ovansida har kontakt med fostervatten och på ovansidan finns de celler som så småningom blir vårt nervsystem och vår hud. Senare krullar det lilla lövet upp sig och nervsystemet och hjärnan hamnar på insidan, medan huden fortfarande är kvar på utsidan.
Efter sju års tålmodigt arbete är tekniken tillräckligt robust för att användas i ett stort forskningsprojekt.
– Nu kommer vi åt över 95 procent av cellerna i hjärnan med den här tekniken. Vi kan också nå cellerna i ryggraden och över 80 procent av cellerna i de så kallade neurala krönen. Dessutom optimerar vi tekniken för att den ska fungera i andra delar av kroppen, som immunsystemet.
Bygger upp cellernas ”släktträd”
Forskarna spårar stamcellerna under deras utveckling till mogna celltyper. Vid olika tidpunkter samlar man in cellerna och kan med hjälp av RNA-sekvensering avläsa de enskilda streckkoderna tillsammans med deras cellidentitet.
– På det sättet kan vi lista ut vem som är släkt med vem och hur nära släkt de är. Vi kan utröna om en cell gett upphov till bara två celler eller kanske flera hundra celler och vi kan bygga upp de mogna cellernas ”släktträd”.
En stor fördel är att tekniken är snabb och flexibel. Dessutom kan man kraftigt dra ner på antalet djurförsök. Musmodeller är en nödvändig del av medicinsk forskning, men att skapa möss för att testa exempelvis olika genmutationer är dyrt och tar lång tid.
– Nu kan vi gå från idé till färdig musmodell på bara några veckor. Dessutom behöver vi inte ta fram en hel koloni, utan en enstaka mus kan ge oss tusen gånger fler svar än idag.
Projektet innehåller flera krävande moment.
– Man måste vara bra på att hantera möss och att utföra mikrokirurgi på foster som är så små att de nästan inte syns. Och när man ska samla in celler och utföra RNA-sekvensering så krävs det att man är snabb och kan ta hand om cellerna så att de håller sig ”glada”.
Projektet resulterar också i stora mängder data som ska analyseras. Allt bygger på ett samarbete med experter från utvecklingsbiologi och neurovetenskap till leverbiologi, immunologi, fysiologi och bioinformatik.
– Det är fantastiskt att få förtroendet att leda ett konsortium med så många ledande forskare. Men vi hade aldrig kunnat genomföra ett så ambitiöst projekt utan finansieringen från Knut och Alice Wallenbergs Stiftelse.
Kan återskapa förlorade celler
I framtiden öppnar forskningen för nya medicinska behandlingar. En vision är att kunna styra cellerna i önskad riktning.
– Vi kanske kan hjälpa hjärnan att återskapa förlorade nervceller, eller hjälpa immunsystemet att välja att tillverka fler celler som behövs vid en infektion.
Emma Anderssons grupp jobbar med en sällsynt barnsjukdom, Alagilles syndrom. Barnen föds utan gallgångar i levern. Hos vissa patienter sker en spontan återhämtning med nybildning av gallgångssystemet, medan andra barn blir så sjuka att de behöver en levertransplantation.
Nu är förhoppningen att med hjälp av djurmodeller och ny kunskap om cellernas utveckling kunna identifiera de faktorer som styr sjukdomens förlopp.
– I framtiden kanske vi förstår hur man kan kickstarta en återbildning av leverceller och hjälpa barnen från att tvingas genomgå en transplantation. Det är en av mina stora drömmar, säger Emma Andersson.
Text Nils Johan Tjärnlund
Bild Stefan Zimmerman, Emma Andersson, Katrin Mangold, Simona Hankeova