Lynn Kamerlin tar hjälp av superdatorer för att förstå hur proteiner har utvecklats under miljarder år av biologisk evolution. Framförallt är hon intresserad av enzymer. Med avancerade biokemiska beräkningar vill hon designa nya effektiva enzymer, bland annat genom att vidareutveckla urgamla proteiners katalytiska förmågor.
Lynn Kamerlin
Professor i cell- och molekylärbiologi
Wallenberg Academy Fellow/Wallenberg Scholar
Lärosäte:
Uppsala universitet
Forskningsområde:
Beräkningsbiologiska studier av enzymers evolution och design
Utan enzymer skulle biologiskt liv vara omöjligt, förklarar Lynn Kamerlin. Enzymer är de proteiner som katalyserar olika kemiska reaktioner i cellerna. De kan öka reaktionshastigheten med flera miljoner gånger.
– Vi lever för att det pågår kemiska reaktioner i kroppen hela tiden. När de stannar så upphör livet. Så att kunna förstå var enzymer kommer ifrån och hur deras funktioner har utvecklats, är att förstå livets evolution på den minsta molekylära nivån.
Lynn Kamerlin, som är professor i cell- och molekylärbiologi vid Uppsala universitet, jämför verkligheten i naturen med en stor fabrik där många olika delar pratar med varandra och arbetar tillsammans. Och där tajmingen måste vara rätt för att allt ska fungera.
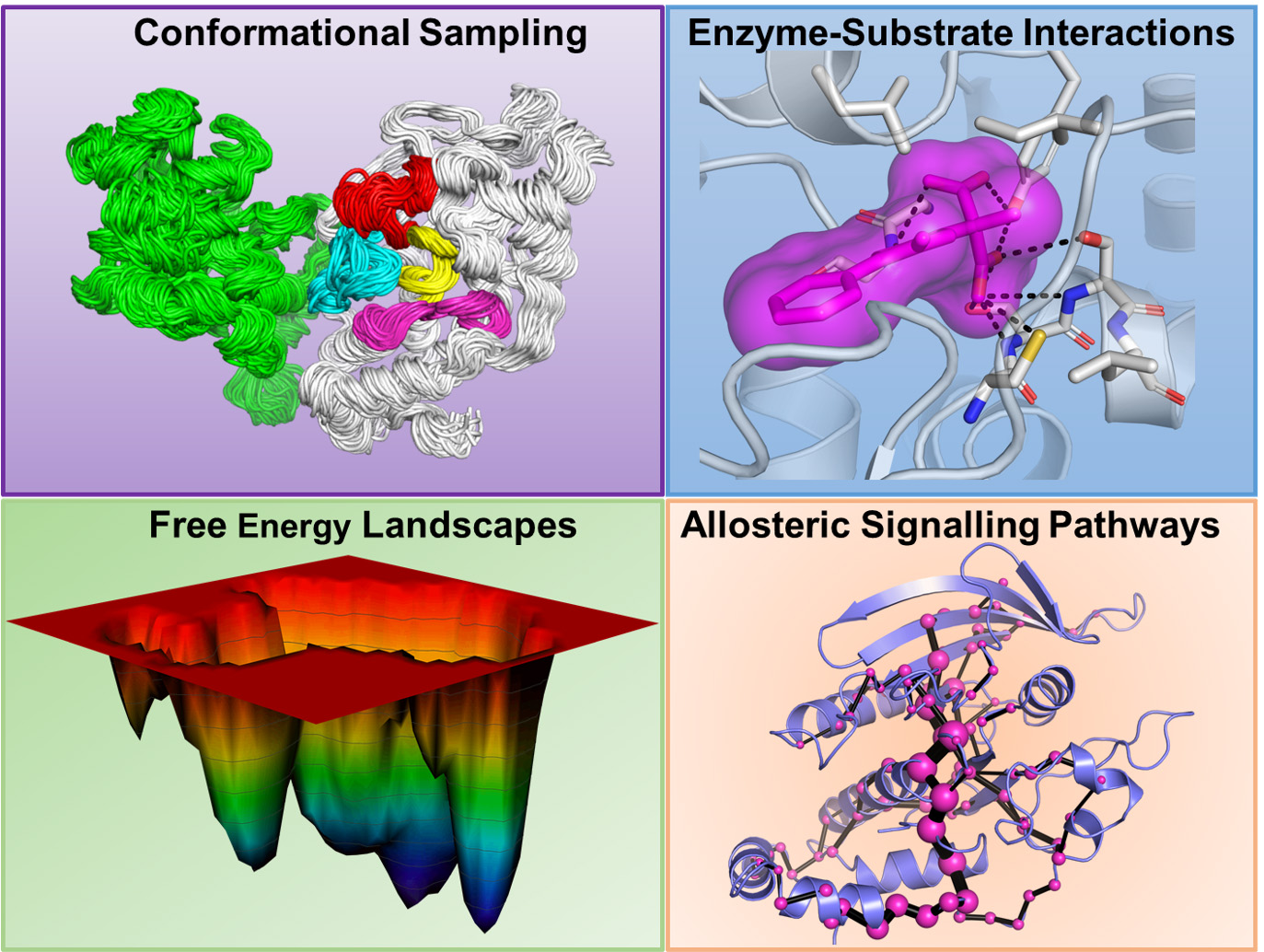
– Det är oerhört komplicerat. Man kan lära sig mycket i ett vanligt våtlabb om de här biologiska processerna och bygga enklare modeller. Det min forskargrupp försöker bidra med är mer komplexa modeller. Vi kan i våra virtuella beräkningslabb använda fysikalisk kemi, matematik och datorvetenskap för att förklara de underliggande processerna som styr livet. Och när man har förstått det kan man till exempel ta fram nya läkemedel för sjukdomar eller innovationer för en hållbar framtid.
Bryta ner pesticider och plast
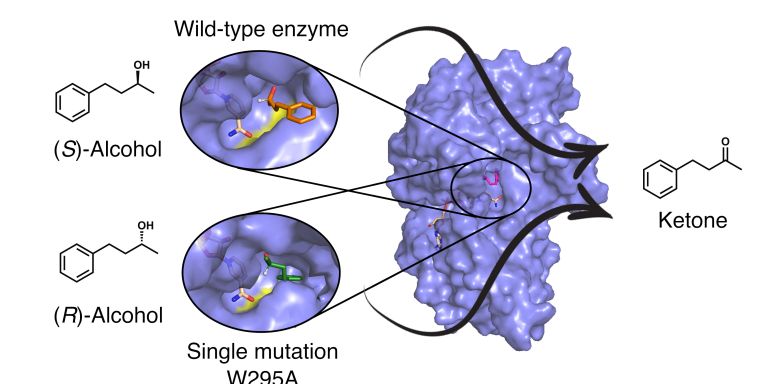
Enzymer kan framställas syntetiskt och skräddarsys för att få specifika egenskaper. De är viktiga katalytiska verktyg inom exempelvis industrier som framställer läkemedel och kemikalier. För att kunna göra dessa syntetiska enzymer behövs kunskap om hur naturens egna proteiner fungerar.
Med hjälp av avancerade beräkningsmodeller och kraftfulla datorkluster studerar Lynn Kamerlin bland annat evolutionen av ett enzym som bryter ned ett giftigt ämne i nervgaser och bekämpningsmedel, pesticider.
– I naturen finns enzymer som bara på några decennier har utvecklats så att de kan bryta ned organofosfater, helt onaturliga ämnen som finns i nervgaser och pesticider. I vissa delar av världen använder man fortfarande organofosfater i jordbruket och de är väldigt giftiga. Genom att lära oss av naturens egna nedbrytande enzymer och vidareutveckla dem, kan vi förhoppningsvis bidra till framtagningen av botemedel mot organofosfatförgiftning.
Forskargruppen undersöker också enzymer som kan bryta ner plast.
– Vi har ett spännande samarbete med kollegor i Chile. De har identifierat nya enzymer som kan bryta ner plast i extremt kalla miljöer som Antarktis. Det vore intressant att se om man kan använda sig av ingenjörskonst för att göra dem bättre. Vi är också väldigt intresserade av att utveckla enzymer som kan bryta ner föroreningar i vatten.
Återskapar urgammalt enzym
Tack vare Wallenberg Scholar-anslaget kan Lynn Kamerlin ta sitt arbete i ännu fler riktningar. Forskargruppen har till exempel återskapat ett flera miljarder år gammalt enzym ur vilket många generationer av nya enzymer har utvecklats. Kunskapen vill de använda för att designa nya enzymer med unika reaktionsegenskaper.
”I forskning handlar det både om att arbeta hårt och att ha tur, för det gäller även att vara på rätt plats vid rätt tid. Att få det här Scholaranslaget är jätteroligt för det möjliggör cool forskning som vi inte kunde ha gjort annars.”
För att få fram gensekvensen på det urgamla proteinet har de använt bioinformatiska tekniker, berättar Lynn Kamerlin. Bioinformatik är en tvärvetenskaplig beräkningsmetod för analys av biologiska data.
– När vi har dna-sekvensen kan vi återskapa det urgamla proteinet. Det har vi sedan jämfört med moderna syntetiska enzymers molekyl- och atomstrukturer. Våra samarbetspartner i Uppsala, på andra ställen i Sverige och runt om i världen, bygger de faktiska enzymerna och gör mätningar på dem i sina labb. Vi vet till exempel att tidigt i evolutionen var proteiner ganska stabila vad gäller värme, medan moderna proteiner faller isär om man värmer upp dem.
Det gamla proteinet visade sig vara bättre än de flesta moderna enzymerna när man testade en specifik katalysreaktion.
– Men ett av de syntetiska enzymerna var riktigt bra. Det hade skapats med designad beräkningskemi, en rent teoretisk modell, och så kallad riktad evolution. Så vi ville se om vi kunde nå samma effektivitet baserat på vårt urgamla enzym. Och faktiskt, vi kunde visa att vi med en ganska enkel designstrategi där vi använder bioinformatiska tekniker och beräkningsbaserad design lyckats skapa ett naturligt enzym som är nästan lika bra som det bästa syntetiska enzymet. Det är vi stolta över.
Hett forskningsområde
Bara under det senaste decenniet har två Nobelpris delats ut för framsteg inom det forskningsområde Lynn Kamerlin verkar inom. År 2013 gick priset till hennes tidigare handledare Arieh Warshel vid University of Southern California i USA, för utveckling inom beräkningskemi. Fem år senare, 2018, fick Francis Arnold vid Caltech i USA priset för riktad evolution och optimering av enzymer. Båda nobelpristagarnas metoder används av Lynn Kamerlin i hennes studier av enzymers evolution och design.
– Jättekul förstås, och ett tecken på att området är viktigt. Det var också en positiv kick och inspiration för alla oss som jobbar inom det här forskningsfältet.
Text Susanne Rosén
Bild Marina Corbella, Mikael Wallenstedt, Rory Crean, Peter Casson, Magnus Bergström