Projektanslag 2020
Decoding bacterial toxin-antitoxin systems: from high-throughput discovery to molecular mechanisms and biotechnology
Huvudsökande:
Dr Gemma Atkinson
Medsökande:
Lunds universitet
Vasili Hauryliuk
Herwig Schüler
Umeå universitet
Magnus Wolf-Watz
Lärosäte:
Lunds universitet
Beviljat anslag:
29,6 miljoner kronor under fem år
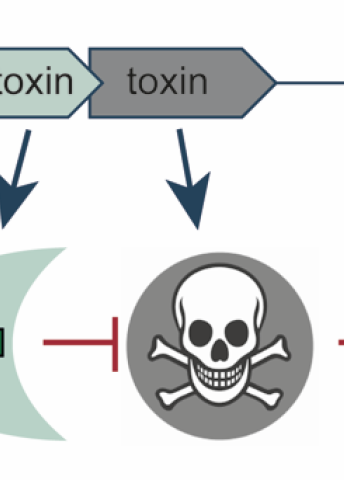
En på- och avknapp i genomet hos många bakterier är känd sedan länge. Det handlar om ett genpar, där den ena genen kodar för ett toxin och den andra för ett antitoxin. Toxinet fungerar som ett gift som hindrar bakteriens tillväxt. Antitoxinet motverkar effekten genom att samverka med toxinet eller neutralisera dess inverkan på bakteriecellen.
– Även virus som infekterar bakterier påverkas av toxin-antitoxinsystemet, förklarar Gemma Atkinson.
Mycket är dock okänt om toxin-antitoxin-parets funktion och varför bakterier har så många olika system. De är svåra att identifiera. Ingen vet hur många det finns.
Undersöker stora datamängder
Gemma Atkinson har tillsammans med övriga forskare i projektet beviljats anslag från Knut och Alice Wallenbergs Stiftelse för att identifiera alla varianter av toxin-antitoxin-par som de kan upptäcka och undersöka vad de gör i en cell. Ett dataverktyg, som hon har utvecklat, har kapacitet att bearbeta stora mängder information och identifiera nya system.
– Hundratals och tusentals gener har sekvenserats hittills, men det finns alla möjliga hemligheter gömda. Det krävs avancerade dataprogram för att hitta dem.
Frågan är varför systemet överhuvudtaget har uppstått. Varför vill en bakterie använda ett toxin för att förgifta sig själv?
– Bakterierna vill inte precis begå självmord utan använder toxinet för att bromsa en process. Ibland behöver bakterien stoppa tillväxten när livsvillkoren inte är de allra bästa, eller för att övervinna en virusattack. När förutsättningarna har förändrats kan de komma igen med ny kraft. Antitoxinet är en väldigt effektiv säkerhetsmekanism för att hålla toxinet i schack när det inte behövs.
Projektet fick nyligen ett genombrott med upptäckten av en familj av antitoxiner som har specialiserat sig på att neutralisera hundratals eller till och med tusentals obesläktade toxiner.
– Det gjorde oss mycket förvånade. Vi kallar den nya antitoxinfamiljen för Panacea efter läkekonstens gudinna i den grekiska mytologin (Panakeia på svenska). Vi tror att det finns fler mekanismer som ännu är okända. Det är spännande att man aldrig vet i förväg vad man kommer att hitta.
Mycket är ännu outforskat. Hur fungerar proteinerna i detalj – och finns det fler antitoxinfamiljer med liknande egenskaper?
Från ny biologi till ny bioteknologi
Projektet kommer att öka kunskapen om bakteriers natur och det universum av proteinfunktioner som inte har blivit upptäckt ännu. Det kan leda till många nya tillämpningar inom vitt skilda områden.
– Att kontrollera bakterietillväxt är viktigt i bioteknik. Inom medicinområdet finns också stora möjligheter. När antibiotika slutar vara verksamma måste vi skapa ett genetiskt vapen för att döda sjukdomsalstrande bakterier. Bakteriofagterapi, fagterapi, är en spännande möjlighet och eftersom toxin-antitoxinsystem har en roll i fagförsvaret förväntar vi oss att de kommer att spela en betydande roll i den framtida utvecklingen av denna teknik.
Hans Adolfsson, rektor vid Umeå universitet, har uttryckt en förhoppning om att projektet ska ha samma potential som den så kallade gensaxen. Professor Emmanuelle Charpentier var forskare just i Umeå när hon upptäckte och utvecklade CRISPR-cas9-systemet, som belönades med ett delat Nobelpris i kemi 2020.
– Mekanismerna är väldigt olika, men båda processerna kan användas i tillämpningar inom både bioteknik och medicin. Vi tror att vi kommer att hitta tusentals nya toxin-antitoxin-system. Det ger oss en stor och unik samling av verktyg som kan användas för att till exempel styra cellens resurser till att producera ett protein eller skapa en liten molekyl av intresse för industrin eller läkemedelstillverkning.
Ny fas för projektet
Just den här dagen ser Gemma Atkinson fram emot ett möte med en av sina doktorander som håller på att utveckla en nättjänst för att hjälpa andra forskare att hitta toxin-antitoxinsystem i sin favoritbakterie.
Både hon och hennes man Vasili Hauryliuk har haft fullt upp i sommar med att flytta både familjen och sina grupper till Lund från Umeå, där de fortfarande har starka band.
– Flytten till en annan miljö innebär ett nytt och spännande steg i vår forskning. Vi ser fram emot alla äventyr och upptäckter som ligger framför oss.
Text Carin Mannberg-Zackari
Bild Ola Nilsson, Vasili Hauryliuk, Gemma Atkinson
Mer om projektet
Fyra grupper vid tre institutioner samarbetar i studien.
Utmaningar inom bioinformatik och molekylär utveckling hanteras av Atkinsons laboratorium medan Vasili Hauryliuk tar sig an frågeställningar inom mikrobiologi och biokemi – båda vid institutionen för experimentell medicinsk forskning på Lunds universitet.
Toxin-antitoxinsystem innehåller ofta protein med ovanliga veck som aldrig har setts tidigare, varför strukturbiologi är en betydelsefull del av projektet. Magnus Wolf-Watz, kemiska institutionen vid Umeå universitet, och Herwig Schüler vid institutionen för biokemi och strukturbiologi, Lunds universitet, leder grupper som svarar för projektets strukturbiologiska forskning.





