Projektanslag 2017
Development of new therapeutic strategies based on the discovery of ZC3H11A
Huvudsökande:
Leif Andersson, professor i funktionsgenomik
Lärosäte:
Uppsala universitet
Beviljat anslag:
43 000 000 under 5 år
18 000 000 kronor för år 2017
25 000 000 kronor för år 2020
Det finns minst 600 kända virus som kan infektera människan. En del klarar kroppen att ganska enkelt försvara sig mot som förkylningsvirus, andra har vi lärt oss hantera med vaccin eller antivirala preparat, några står vi fortfarande handfallna inför, de leder till kroniska besvär, ett fåtal ofelbart till döden.
På grund av pandemin pratar vi numera nästan dagligen om virus men det var faktisk först på 1930-talet, när elektronmikroskopet uppfanns, som virus upptäcktes. I och med SARS-coV-2 viruset har vikten av att, vid sidan av vaccin, också hitta nya virushämmande behandlingar aktualiserats. De är viktiga eftersom de kan användas när man redan blivit infekterad.
Leif Andersson och hans forskargrupp har kommit en gen på spåren som hämmar tillväxten för några viktiga virus som orsakar besvär och lidande och som i vissa fall kan leda till döden om man inte får behandling: adenovirus, influensavirus, herpesvirus och hiv. Samma gen ZC3H11A verkar också kunna påverka tillväxten av cancertumörer, i alla fall i möss.
– Man kan säga att vi har två spår i projektet, dels att förstå hur ZC3 – som vi förkortat kallar genen – påverkar virusets replikation, alltså hur det förökar sig, dels hur det påverkar tumörtillväxt, säger Leif Andersson, professor i funktionsgenomik vid Uppsala universitet.
Grisar bakom upptäckten
De första pusselbitarna lades av Leif Andersson och hans kollegor redan i slutet av 1980-talet. Då arbetade de med att kartlägga grisens arvsmassa och de genetiska skillnaderna mellan vildsvin och tamsvin. De flesta och största pusselbitarna kom sedan när första kartläggningen av den mänskliga arvsmassan presenterades år 2000.
– Det var en milstolpe i genetiken. Många av de 20 000 proteinkodande generna är väldigt väl studerade och vi vet vilka sjukdomar som är kopplade till förändringar i dem men för många gener har vi fortfarande dålig kunskap om exakt vilken funktion de har i kroppen och cellerna.
År 2003 kunde Leif Anderssons forskargrupp i tidskriften Nature publicera hur samspelet mellan ett okänt protein och genen för en tillväxtfaktor var viktigt för att reglera muskeltillväxten hos grisar. Några år senare kunde de också identifiera det tidigare okända zinkfingerproteinet som de döpte till ZBED6.
– När man presenterade det mänskliga genomet hade man missat det. Det satt inne i en annan gen, ZC3H11A, ungefär som i ryska Matrjosjka-dockor. Vi började då också fundera på vilken betydelse ZC3 har.
De bestämde sig för att inaktivera genen genom att klippa bort den med gensaxen, Crispr-Cas9-metoden, och se vad som skulle ske.
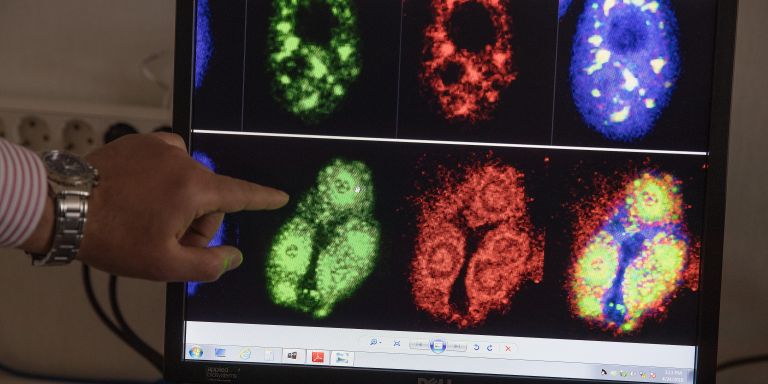
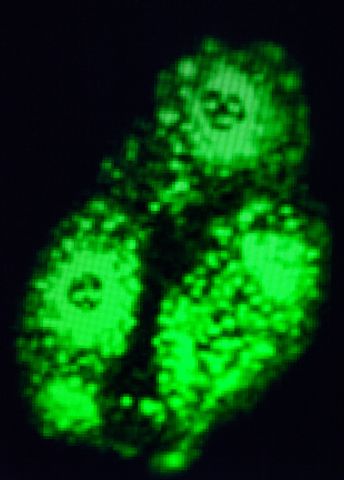
– Det hände inte mycket. Men när vi försökte stressa cellen genom att infektera den med virus hände något oväntat, viruset fick problem med att replikera, föröka sig, i cellkärnan. Antalet viruspartiklar minskade drastiskt.
Viktig funktion
Inte alla, men flera medicinskt viktiga virus replikerar i cellkärnan. Adenovirus, influensavirus, herpesvirus och hiv tillhör dessa.
– Det visade sig att transporten av virusets RNA från cellkärnan till cytoplasman störs. Här finns alltså ett fönster för att styra hur ZC3 påverkar virus och en möjlighet att utveckla ett virushämnade läkemedel. Vi har också lovande resultat för några molekyler.
Men Leif Andersson tror inte att upptäckten har någon betydelse för att bekämpa coronaviruset.
– Vi ska givetvis undersöka det men vi tror det är osannolikt eftersom coronavirus inte replikerar i cellkärnan. Det vi däremot har lärt oss under åren är att proteinet verkar ha fler funktioner. Förutom att det påverkar stresshanteringen i cellen förefaller den ha en roll i regleringen av immunsystemet. Det vi lär oss om detta kan få ännu större betydelse än om transporten av virus mRNA.
Detta hänger i sin tur ihop med cancerspåret. Cancertumörer är stressade, de kräver näring och blodtillförsel för att föröka sig.
– ZC3H11A är ett stressrelaterat protein. För immunförsvaret är det viktigt att hitta en balans mellan gas och broms, något som direkt är kopplat till immunterapi mot cancer. Vi vet inte exakt hur ZC3 medverkar i regleringen av immunsystemet, om det är indirekt eller direkt, beroende på vilka proteiner som transporteras ut ur cellkärnan under stress. Men vi kan redan nu säga att det finns en koppling mellan ZC3:s funktion och vissa tumörformers utveckling.
Men det grundläggande för forskargruppen är att förstå funktionen av ZC3, var det finns i cellen och vilka proteiner det interagerar med.
– Innan vår studie visste man väldigt lite. Vi har sett att det i stort sett finns i alla celler vilket tyder på att det har en basal funktion hos däggdjursceller. Om man slår ut ZC3 genen i en mus så föds den inte, vilket tyder på att den också har en viktig funktion under fosterutvecklingen.
Om projektet som stöds av Knut och Alice Wallenbergs Stiftelse resulterar i ett antiviralt läkemedel och en ny cancerterapi är svårt att säga.
– Vi kommer att bygga upp grundläggande kunskap. Sedan måste industrin ta över för att reda ut om detta kan leda fram till en framgångsrik terapi. Det är alltid svårt att veta om läkemedelsutveckling lyckas eller inte, konstaterar Leif Andersson.
Text Carina Dahlberg
Bild Mikael Wallerstedt, Magnus Bergström